RDC 318: estudo de estabilidade de medicamentos e o impacto da temperatura
A RDC 318 foi publicada em 2019 e se tornou o documento de referência para os estudos de estabilidade de medicamentos novos e de Insumos Farmacêuticos Ativos (IFA).
A resolução traz orientações para o processo de análise da estabilidade nas indústrias. A partir disso, essas empresas conseguem definir o prazo de validade dos produtos e as condições ideais de armazenagem que devem ser implementadas em todas as etapas da logística farmacêutica — distribuição, transporte e armazenagem em serviços e pontos de venda.
Mas o que é a estabilidade de um medicamento e por que é importante analisá-la?
A estabilidade de um medicamento é a capacidade de manter suas propriedades físicas, químicas, microbiológicas, terapêuticas ou toxicológicas por um período determinado.
Ou seja, um medicamento estável é aquele que continua seguro e eficaz durante todo o período de validade indicado pela fabricante em sua bula e embalagem.
Se a estabilidade é afetada, a saúde de pacientes e consumidores fica em risco, e todos os serviços de saúde e do varejo farmacêutico ficam sujeitos a perdas e prejuízos.
É importante destacar, entretanto, que a RDC 318 trata sobre a estabilidade de medicamentos e IFA, mas não se aplica aos produtos biológicos, cuja resolução correspondente é a RDC 412 de 2020. Além disso, há outros documentos, inclusive da Anvisa, que complementam o assunto.
Para saber mais sobre a estabilidade de medicamentos e como fabricantes chegam à faixa de temperatura e umidade ideal, continue a leitura desse guia SyOS.
RDC 318: por que a estabilidade dos medicamentos e vacinas precisa ser testada?

O objetivo dos estudos de estabilidade é garantir que os medicamentos permaneçam eficazes desde a sua fabricação até o término do prazo de validade. Para isso, é necessário conhecer as condições ideais de armazenagem dos medicamentos.
Essas informações também contribuem para a gestão da qualidade desses produtos, auxiliando indústrias e serviços de saúde a planejar suas operações e evitar a degradação antecipada dos produtos.
[TABELA] Conheça os tipos de estabilidade de medicamentos e substâncias ativas
A degradação causada por procedimentos inadequados está associada à redução da potência e da eficácia dos produtos. Além disso, ela também pode estimular o crescimento de microrganismos e gerar compostos tóxicos que tornam os medicamentos inseguros e prejudiciais à saúde.
Veja na tabela abaixo 5 tipos de estabilidade de medicamento:

Condições externas ou ambientais que causam perda de estabilidade nos medicamentos
Veja abaixo as condições ambientais que mais impactam na estabilidade dos medicamentos ou insumos farmacêuticos ativos.
1) Temperatura
A temperatura é a condição ambiental mais importante para a qualidade dos medicamentos. Isso ocorre porque variações acima da faixa recomendada aceleram reações químicas e biológicas nos produtos, antecipando sua decomposição e, consequentemente, reduzindo o prazo de validade.
2) Umidade
A umidade é capaz de afetar alguns medicamentos a depender de sua forma farmacêutica, contribuindo para a proliferação de fungos e bactérias e para o desencadeamento de alterações químicas e físicas.
Além disso, a umidade também pode modificar a consistência dos medicamentos, afetando odor, cor e sabor, além de acelerar seu tempo de desintegração.
Esses e outros impactos da temperatura e da umidade são explicados no Informe Técnico de Assistência Farmacêutica nº12 (Maio/2020) da Prefeitura de Rio Preto.
3) Luz
A luz pode agir sobre os medicamentos ou substâncias ativas desencadeando degradações como redução e oxidação. Além disso, também tem impacto na velocidade de reação dos medicamentos.
Condições próprias dos medicamentos que causam perda de estabilidade
Além da temperatura, da umidade e da luz, outras condições afetam os medicamentos, como a hidrólise (pH ácido/básico) e reação de oxidação (que também é afetada por fatores extrínsecos como luz, temperatura e umidade).
Outros detalhes do impacto da luz e de condições intrínsecas aos medicamentos podem ser consultados na pesquisa “Estudo de estabilidade de medicamentos”, publicada na Revista Acadêmica Oswaldo Cruz.
O que é estudo de estabilidade de medicamentos: veja os diferentes tipos

Um estudo de estabilidade permite testar e produzir evidências da variação de qualidade sofrida ao longo do tempo por um medicamento ou por um Insumo Farmacêutico Ativo (IFA).
Mas como o estudo chega aos resultados?
Os resultados são obtidos a partir de análises da influência de fatores ambientais, como temperatura e umidade, e das características intrínsecas aos produtos, como suas propriedades físicas e químicas, a forma farmacêutica, o processo de fabricação e os materiais de embalagem.
Com o resultado dos estudos, é possível estabelecer os cuidados de conservação dos produtos assim como seu prazo de validade e prazo de reteste.
Entenda melhor essas processo vendo quais são os tipos de estudo de estabilidade segundo a RDC 318 a seguir:
1) Estudo de estabilidade de medicamento ou IFA
O estudo de estabilidade é um estudo projetado, ou seja, é um estudo cujo objetivo é fazer uma estimativa. Nesse caso, a estimativa é sobre o prazo de validade, o prazo de reteste e os cuidados de conservação do medicamento.
Essa projeção se torna possível através da testagem do medicamento ou IFA e da produção de evidências sobre sua variação em função do tempo.
Veja a seguir que tipos de informações o estudo de estabilidade traz segundo a RDC 318/2019:
- Cuidados de conservação: os cuidados de conservação se referem a todas as condições ambientais (como temperatura e umidade) recomendadas para o armazenamento do medicamento ou IFA.
- Prazo de validade: o prazo de validade indica por quanto tempo o medicamento ou IFA é estável desde que as condições de conservação e armazenagem sejam garantidas.
- Prazo de reteste: o prazo de reteste indica o tempo que deve transcorrer até uma nova realização de teste do material.
2) Estudo de estabilidade de longa duração
A RDC 318 também define o estudo de estabilidade de longa duração como um estudo projetado.
A diferença, nesse caso, é que o estudo de longa duração verifica as características físicas, químicas e microbiológicas do medicamento sob as condições de armazenagem e o prazo de validade propostos.
3) Estudo de estabilidade acelerado
Esse estudo avalia possíveis alterações físicas, químicas e microbiológicas de medicamentos ou IFA sob condições forçadas de armazenamento.
O estudo acelerado ajuda na definição do prazo de reteste do medicamento e também na avaliação do impacto que excursões fora dos cuidados de conservação adequados.
Por exemplo: um estudo acelerado de um medicamento termolábil (faixa entre 2°C e 8°C) permite conhecer a impacto que variações de temperatura acima dos 8°C por um breve período têm sobre os medicamentos.
4) Estudo de estabilidade de acompanhamento
Como o nome já sugere, o estudo de acompanhamento faz parte de um processo de monitoramento periódico dos produtos.
Por isso, o estudo de acompanhamento permite confirmar os prazos de validade e de reteste, conforme descrito pela RDC 318.
5) Outros tipos de estudo de estabilidade
Há diversos tipos de estudo de estabilidade aplicados na análise de medicamentos e IFA, com o estudo de estabilidade em uso, o estudo de estabilidade reduzido e o estudo de fotoestabilidade.
As definições e características de cada um estão descritas na RDC 318/2019 da Anvisa.
Confira também uma lista do que um estudo de estabilidade de medicamentos deve comprovar:
- que o produto tem qualidade, eficácia e segurança;
- que alterações pós-registro não comprometem a qualidade, a eficácia e a segurança do produto;
- que prazo de validade e as condições apropriadas de armazenamento estabelecidos pelo estudo são adequados;
- que os resultados dos estudos de estabilidade são adequados.
Entre outras comprovações que podem ser consultadas no Guia de Estudos de Estabilidade nº 28 da Anvisa (2019).
Normas e documentos importantes sobre estabilidade de medicamentos

Para garantir a qualidade dos medicamentos, a Anvisa publica uma série de normas que trazem Boas Práticas, critérios e procedimentos necessários para estabelecer o prazo de validade e as condições ideais de armazenamento dos produtos farmacêuticos. Veja as principais:
1) RDC 318/2019 — Estabilidade de medicamentos e IFA
A Resolução da Diretoria Colegiada (RDC) 318/2019 trata sobre os estudos de estabilidade de Insumos Farmacêuticos Ativos (IFA) e medicamentos prontos, exceto os biológicos. Este documento da Anvisa estabelece os critérios e condições para a realização dos estudos de estabilidade, visando garantir a qualidade dos medicamentos ao longo de sua vida útil.
2) RDC 412/2020 — Estabilidade de produtos biológicos
A RDC 412/2020 da Anvisa trata dos estudos de estabilidade de produtos biológicos, tanto para fins de registro quanto para alterações pós-registro. Este documento é essencial para garantir que os produtos biológicos mantenham sua eficácia e segurança durante todo o período de validade.
3) Guia nº28/2019 de Estudos da Estabilidade
O Guia nº 28/2019 da Anvisa fornece orientações detalhadas sobre a condução de estudos de estabilidade para medicamentos. Esse guia é um recurso valioso para as empresas farmacêuticas, ajudando a cumprir as exigências regulatórias e assegurar a qualidade.
4) Pergunta & Respostas Anvisa – Estabilidade de produtos biológicos
A Anvisa frequentemente disponibiliza uma seção de perguntas e respostas e há uma versão do documento que foca especificamente na estabilidade de produtos biológicos, oferecendo orientações detalhadas para o setor.
É uma fonte importante para esclarecer dúvidas e garantir o cumprimento das normas estabelecidas pela RDC 412/2020.
O documento também aborda as faixas de temperatura recomendadas para medicamentos termolábeis e para medicamento que podem ser armazenamento em temperatura ambiente.
5) Perguntas & Respostas Anvisa – Orientações sobre cuidados de conservação de medicamentos
Este documento de perguntas e respostas traz orientações sobre os cuidados de conservação de medicamentos.
As orientações são úteis tanto para profissionais de saúde quanto para empresas e consumidores, fornecendo informações claras e objetivas sobre a melhor forma de armazenar medicamentos.
6) Resolução RE 01/2005 (Revogada pela RDC 318/2019)
Embora a Resolução RE 01/2005 tenha sido revogada pela RDC 318/2019 da Anvisa, ela foi um documento importante que orientou os estudos de estabilidade por muitos anos.
7) RDC 430/2020 e RDC 653/2021 — Temperatura e umidade na armazenagem e distribuição de termolábeis
As RDCs 430 e 653 também se relacionam com a estabilidade dos medicamentos porque são as resoluções vigentes que determinam as Boas Práticas de distribuição, armazenagem e transporte de medicamentos.
Para saber mais detalhes sobre ambas as resoluções que exigem um rígido controle de temperatura e umidade de medicamentos termolábeis, baixe nosso e-book gratuito.
SyOS: monitoramento de temperatura em tempo real para garantir a estabilidade de medicamentos
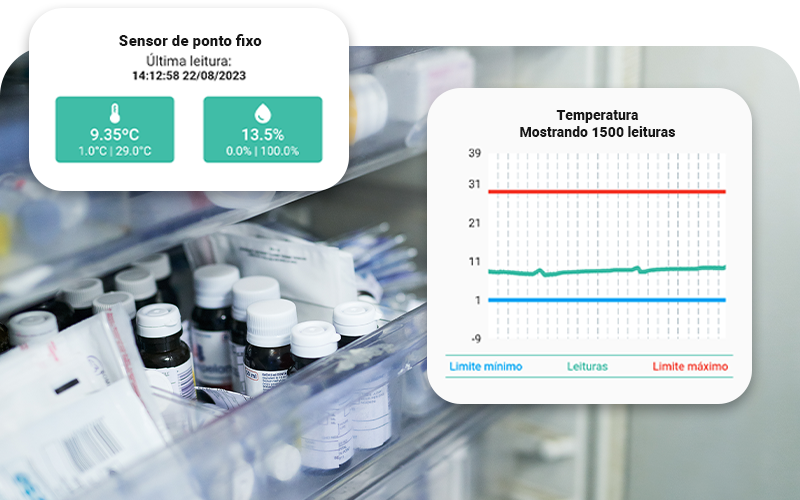
A SyOS é uma startup que desenvolve tecnologia de monitoramento de temperatura e umidade com sensores conectados à internet.
Veja algumas vantagens do nosso sistema validável de monitoramento farmacêutico:
- Conformidade com a Anvisa: siga das Boas Práticas da RDC 430 com um sistema que atende aos requisitos do Guia de Validação de Sistemas da Anvisa;
- Conformidade com a FDA dos EUA: atendemos aos critérios do 21 CFR Part 11 da U.S. Food and Drug Administration;
- Dados online em tempo real: os sensores trabalham 24h por dias garantindo dados contínuos para consulta a qualquer momento;
- Alertas de produto em risco: saiba quando ocorreu uma excursão de temperatura ou umidade com um assistente automático trabalhando 24h.
- Relatórios: garantimos o registro seguro de dados por até 5 anos com emissão de relatórios personalizáveis;
- Sensor de temperatura e umidade: nossos dispositivos têm alta acurácia de medição e certificado de calibração emitido por laboratórios acreditados pela RBC (Rede Brasileira de Calibração).
Solicite sua demonstração gratuita e veja como o sistema validável da SyOS monitora temperatura e umidade para garantir a estabilidade de seus medicamentos.
Sobre a SyOS
Somos uma startup que tem o objetivo de revolucionar a cadeia do frio no Brasil, através de tecnologias de IoT e Inteligência Artificial aplicadas no monitoramento de produtos que precisam de uma temperatura ideal para manter sua qualidade, como alimentos, vacinas e medicamentos.
Com isso, empresas que atuam com a gestão do frio têm acesso a dados, relatórios e alertas que ajudam a tomar decisões para otimizar suas operações, evitar a não conformidade e reduzir prejuízos.
Descubra mais sobre a SyOS ou entre em contato com o nosso time de especialistas para conhecer melhor nossa solução.

![[Grátis] RDC 430: Distribuidora de medicamentos e Transportadora Controle de temperatura de acordo com a Anvisa](https://no-cache.hubspot.com/cta/default/8356687/interactive-197771339293.png)