FDA 21 CFR Part 11: entenda a certificação da agência reguladora dos EUA
O 21 CFR Part 11 aparece na rotina de muitos profissionais do setor farmacêutico e da cadeia de distribuição. Por conta disso, é comum que gere dúvidas sobre seu significado e sua função.
Essa sigla se trata de um código regulamentar da U.S. Food and Drug Administration (FDA) — a agência reguladora dos setores farmacêutico e alimentício nos EUA — e seu objetivo é tornar os registros eletrônicos e as assinaturas digitais mais seguros, autênticos e invioláveis em sistemas eletrônicos.
Com a definição de práticas importantes para segurança de dados, a FDA garante processos e produtos mais eficazes em dois setores que têm impacto na saúde pública norte-americana.
Mas por que o 21 CFR Part 11 é importante para empresas brasileiras?
Como a cadeia de suprimentos é conectada globalmente, se uma empresa exporta produtos médicos ou medicamentos para o mercado dos EUA, ela deve seguir as regras da FDA.
Se você quer entender quais são as regras do 21 CFR Part 11, a relação desse regulamento com a validação de sistemas e como esses processos impactam as empresas brasileiras da área da saúde, continue a leitura desse guia SyOS.
O que é a FDA?

A FDA desempenha um papel central na proteção da saúde pública e na regulação de alguns setores dos EUA. Veja abaixo alguns exemplos de produtos controlados pela agência:
- Medicamentos (tanto para humanos quanto para animais): a FDA avalia e aprova medicamentos para uso humano e animal, garantindo sua eficácia e segurança.
- Alimentos: é papel do órgão regular a segurança dos alimentos consumidos nos EUA, incluindo a rotulagem, o uso de aditivos alimentares e segurança alimentar como um todo.
- Equipamentos e dispositivos médicos: a agência regula dispositivos médicos como equipamentos de diagnóstico, próteses e instrumentos cirúrgicos.
- Produtos derivados de sangue humano: é papel da agência supervisionar a segurança e eficácia desses produtos.
- Cosméticos: a FDA estabelece regulamentações para cosméticos, incluindo o uso ingredientes e o processo de rotulagem.
Além da regulação desses produtos, também é função da FDA a comunicação com todos os agentes e empresas dos setores regulados, assim como a emissão de alertas de segurança e a coordenação do recall de produtos.
Outra função da FDA é a regulação da validação de sistemas, que tem relação direta com o código regulamentar 21 CFR Part 11. Entenda qual é a relação entre esses dois temas a seguir.
O que é 21 CFR Part 11 da FDA?
O 21 Code of Federal Regulations (CFR) Part 11 determina os requisitos obrigatórios para garantir dados seguros e invioláveis em sistema usados no setor farmacêutico.
Exemplos de sistemas sujeitos a esse regulamento são os sistemas de rastreabilidade de medicamentos na cadeia de distribuição e os sistemas de monitoramento de temperatura e umidade.
O uso desses sistemas é uma tendência do mercado farmacêutico, permitindo a automatização de processos e o uso de inteligência de dados para implementar melhoria contínua em processos.
Benefícios de se certificar com o 21 CFR Part 11
A certificação do 21 CFR Part 11, além de ser uma exigência para atuar diretamente ou com parceiros do mercado norte-americano, também prepara as empresas para um melhor controle de qualidade dos seus produtos.
O acesso a dados confiáveis e informatizados permite agir contra perdas e desvios de qualidade, elaborar melhores planos de contingência e acessar dados e forma rápida em auditorias e inspeções farmacêuticas.
Mas é importante destacar que a certificação do 21 CFR Part 11 não ocorre de maneira isolada — ela é apenas um requisito de um processo maior: o de Validação de Sistemas Computadorizados (VSC).
A relação entre a Validação de Sistemas e o 21 CFR Part 11

A Validação de Sistemas Computadorizados é exigida tanto pela FDA dos EUA quanto pela Anvisa do Brasil. Os requisitos feitos pelas duas agências reguladoras são baseados no GAMP®5, um guia internacional de validação criado pela International Society for Pharmaceutical Engineering (ISPE).
Mas por que a validação é importante?
Quando uma empresa implementa um sistema computadorizado, ela busca automatizar um processo que antes era manual ou semiautomático — como o monitoramento de temperatura, por exemplo.
Desse modo, quando um sistema automatizado é validado, as empresas têm um atestado que comprova que eles funcionam da maneira esperada e, portanto, são eficazes.
A certificação do 21 CFR Part 11 entra nesse processo como um complemento que comprova a segurança do registro de dados e assinaturas digitais contra alterações não autorizadas, fraudes e demais violações de dados.
Confira alguns requisitos do 21 CFR Part 11
O 21 CFR Part 11 é um documento detalhado com diversas orientações para garantir a segurança do registro de dados e a confiabilidade de assinaturas eletrônicas.
Separamos abaixo os principais pontos em relação a esses itens para empresas do setor farmacêutico. Confira:
1. Validação dos sistemas e procedimentos
O regulamento exige que os sistemas utilizados sejam validados, garantindo a segurança geral dos processos.
2. Trilhas de auditoria
Todos os registros e alterações de dados devem ter identificação de data e hora de alteração, assim como a criação ou exclusão de arquivos importantes (como relatórios). Processos importantes para garantir o andamento de auditorias farmacêuticas.
3. Requisitos para assinaturas eletrônicas
As assinaturas eletrônicas devem incluir identificações importantes dos administradores e usuários dos sistemas como data e hora de sua realização, assim como demais detalhes de sua revisão e aprovação.
4. Registro seguros de dados
Os dados registrados pelos sistemas devem ser armazenados em formatos variados que permitam sua consulta em autoinspeções interna e inspeções (auditorias) regulatórias.
Todos os registros devem ter acesso rápido para quando forem solicitados.
Conheça o sistema de monitoramento SyOS certificado pelo 21 CFR Part 11 da FDA
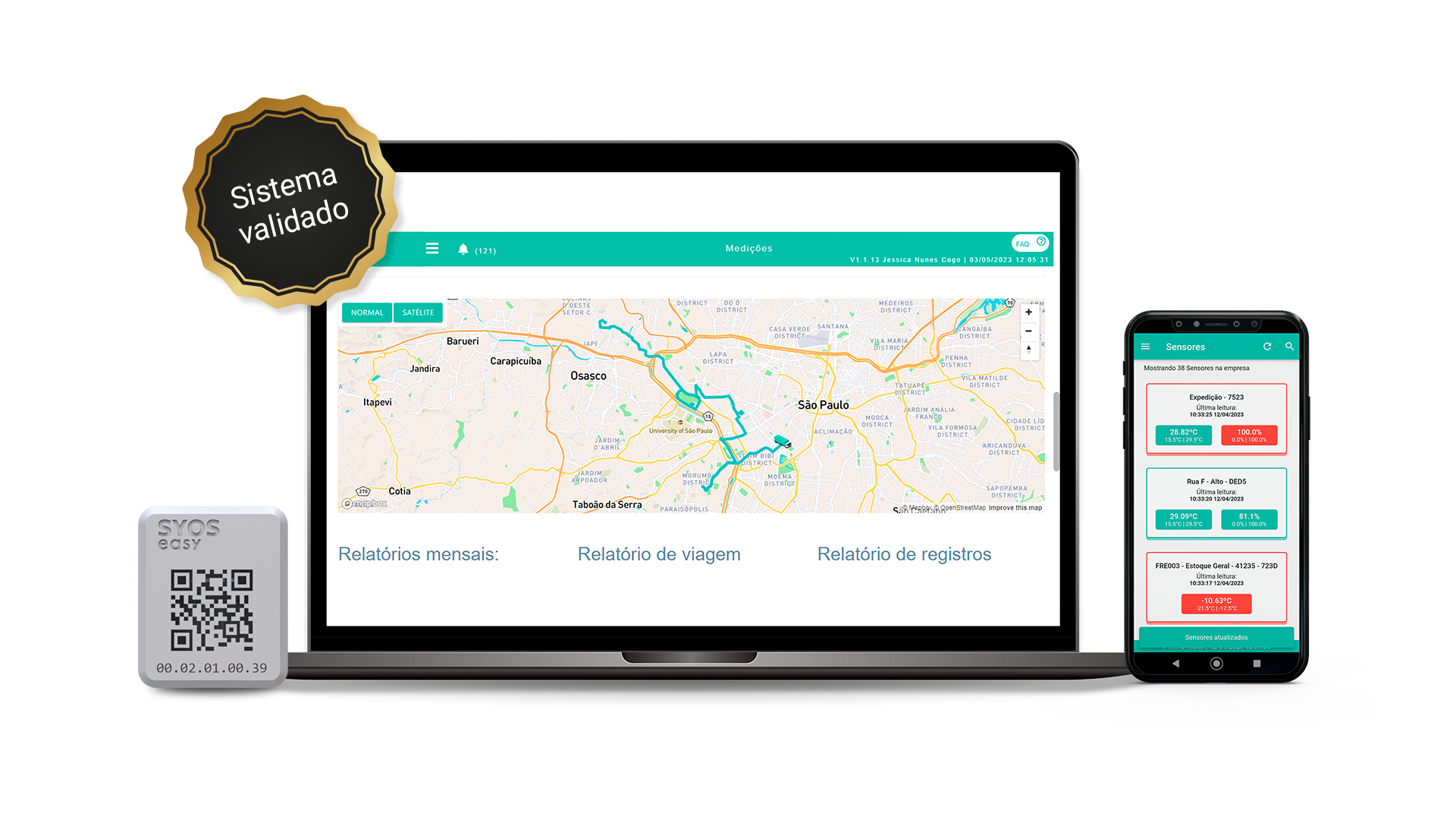
A SyOS desenvolve tecnologia de monitoramento de temperatura e umidade que se adequam à Boas Práticas exigidas pela Anvisa no setor farmacêutico.
Nosso sistema de monitoramento farmacêutico possui a certificação do 21 CFR Part 11 para empresas que desejam prestar serviços para o mercado norte-americano com garantia de segurança e inviolabilidade dos dados de temperatura e umidade.
O sistema SyOS também é validado pela Anvisa e se adequa à RDC 430 para transportadora e distribuidora de medicamentos que precisam se adequar à norma da Anvisa que entrou em vigor.
Agende agora uma demonstração gratuita do nosso sistema validado e veja na prática os benefícios para empresas do setor farmacêutico.
Sobre a SyOS
Somos uma startup que tem o objetivo de revolucionar a cadeia do frio no Brasil, através de tecnologias de IoT e Inteligência Artificial aplicadas no monitoramento de produtos que precisam de uma temperatura ideal para manter sua qualidade, como alimentos, vacinas e medicamentos.
Com isso, empresas que atuam com a gestão do frio têm acesso a dados, relatórios e alertas que ajudam a tomar decisões para otimizar suas operações, evitar a não conformidade e reduzir prejuízos.
Descubra mais sobre a SyOS ou entre em contato com o nosso time de especialistas para conhecer melhor nossa solução.