Controle de qualidade de medicamentos: funções, normas e monitoramento
Você sabe qual é a importância do controle de qualidade de medicamentos? Quando um produto chega ao consumidor em clínicas, hospitais ou farmácias, a garantia de que ele será eficaz é resultado de um longo e minucioso controle de qualidade.
Para produzir medicamentos em larga escala garantindo as características desejáveis, toda indústria deve instituir um Sistema de Gestão da Qualidade (SGQ) que define a padronização de procedimentos e acompanha de perto sua execução em todas as etapas de fabricação, armazenagem e transporte.
Neste guia da SyOS, você vai descobrir como funciona o controle de qualidade em uma indústria farmacêutica de acordo com a RDC 658 da Anvisa, sua importância para o sucesso operacional e variáveis que devem ser monitoradas por essa área, como a temperatura e a umidade nos ambientes que armazenam insumos e produtos farmacêuticos.
Boa leitura!
Funções e responsabilidades do controle de qualidade na indústria farmacêutica

Dentro de uma indústria, o controle de qualidade é parte do Sistema da Gestão da Qualidade Farmacêutica (SGQ) e tem como responsabilidade avaliar todos os processos produtivos.
Para desempenhar esse trabalho com sucesso, essa área precisa ter autonomia em relação à área de produção. Essa autonomia é necessária para a certificação de que os produtos cumprem os requisitos mínimos de qualidade e podem ser liberados para a expedição.
Mas como o controle de qualidade cumpre esse objetivo?
Segundo a RDC 658, todo controle de qualidade deve ter funções determinadas: elas incluem atividades como a definição de especificações para produtos e procedimentos, a execução de testes de qualidade e a organização e documentação para a liberação de produtos.
Abaixo, você pode conferir outras funções desempenhadas pelo controle de qualidade farmacêutico:
- estabelecer, validar e implementar todos os processos de controle de qualidade;
- supervisionar o controle da referência e a retenção de amostras de materiais e produtos;
- garantir a etiquetagem correta de produtos;
- participar da investigação de reclamações sobre a qualidade do produto;
- entre outras funções.
Além das funções descritas acima, todas as atividades do controle de qualidade devem ser feitas com base em procedimentos predefinidos e registrados (os chamados POP – Procedimentos Operacionais Padronizados).
Boas Práticas e requisitos mínimos para o controle de qualidade de medicamentos segundo a RDC 658
A definição de funções para o controle de qualidade é importante para garantir que cada etapa produtiva tenha responsáveis por garantir a qualidade dos produtos.
Mas para que essas funções sejam desempenhadas, o SGQ também precisa seguir Boas Práticas e requisitos mínimos para o seu funcionamento. Confira alguns requisitos importantes abaixo:
- ter pessoal qualificado e treinado para o desempenho de todas as atividades;
- disponibilizar instalações e áreas adequadas;
- ter equipamentos e serviços apropriados;
- fazer o registro de procedimentos e de desvios;
- usar materiais, recipientes e rótulos corretos;
- ter procedimentos e instruções aprovados de acordo com o Sistema da Qualidade Farmacêutica;
- dispor de armazenagem e transporte adequados;
Outra atividade que integra as Boas Práticas de Fabricação (BPF) é o monitoramento das condições ambientais na fabricação, na armazenagem e no transporte. Para entender como ele deve ser feito, continue a leitura.
A relação entre controle de qualidade e condições ambientais
Se as condições ambientais afetam os produtos, é necessário controlá-las e avaliá-las continuamente.
Temperatura e umidade são dois exemplos de variáveis com impacto na qualidade. Nessa lista, podemos somar outras como a ventilação dos ambientes, a iluminação, a presença de vibração, interferências elétricas e até mesmo a limpeza (em relação à presença de microrganismos e impurezas no ambiente).
Ao ter dados sobre essas condições, os profissionais do controle de qualidade conseguem entender e agir sobre qualquer evento que afete a qualidade dos produtos, evitando não conformidades.
Para entender com mais detalhes as regras para o monitoramento dos ambientes, conheça algumas resoluções da Anvisa que devem ser seguidas pelo controle de qualidade farmacêutico.
As principais normas e legislações para o controle de qualidade de medicamentos

A principal norma para o controle de qualidade farmacêutico no Brasil é a Resolução de Diretoria Colegiada (RDC) 658. Também conhecida como a RDC de Boas Práticas de Fabricação (RDC BPF), ela foi publicada em 2022 e atualiza normas anteriores, como a RDC 301.
A RDC 658 descreve de forma minuciosa o que é necessário para garantir a qualidade na fabricação de medicamentos: um dos destaques é a necessidade de melhorias contínuas nos processos. Conheça outros destaques da resolução a seguir.
RDC 658 e o monitoramento contínuo na fabricação
Uma das principais definições da RDC 658 é a documentação de todas as atividades do Sistema de Gestão Qualidade farmacêutico, assim como o acompanhamento de sua efetividade através do uso de sistemas de monitoramento e controle de processos.
Os resultados obtidos a partir desse monitoramento devem ser levados em consideração para a liberação de lotes, para a investigação de desvios no padrão de qualidade e, inclusive, para a realização de ações preventivas (CAPAs), que são executadas para evitar desvios.
É importante destacar: a RDC 658 determina que o monitoramento deve ser aplicado nas indústrias (fabricação e armazenagem), mas ela também abrange aos prestadores de serviços terceirizados relacionados às BPF.
Isso significa que as indústrias podem exigir a rastreabilidade de dados de monitoramento aos seus parceiros, incluindo os que armazenam e os distribuem seus produtos.
Para entender melhor isso, veja mais RDCs da Anvisa que falam sobre a armazenagem e o transporte de medicamentos.
RDC 430 e RDC 653: monitoramento no transporte e na armazenagem
A RDC 430/2020 e a RDC 653/2022 também são importantes para o controle de qualidade farmacêutico, pois complementam a RDC específica para a fabricação trazendo definições importantes para a logística farmacêutica.
Veja alguns detalhes definidos pela RDC 430 e pela RDC 653:
- Boas Práticas de distribuição, armazenagem e transporte (BPDA, BPT, BPx);
- a exigência de controle e monitoramento de temperatura e umidade;
- especificações para garantir a qualidade de medicamentos termolábeis;
- a adoção de sistemas passivos ou ativos de controle de temperatura e umidade;
- prazos para fazer a qualificação térmica e o mapeamento de rotas;
- prazos para a adoção de soluções de monitoramento de temperatura e umidade;
Entre outras definições importantes para garantir a qualidade de produtos farmacêuticos sensíveis à temperatura na logística farmacêutica.
Conheça o jeito SyOS de monitorar para o controle de qualidade de medicamentos
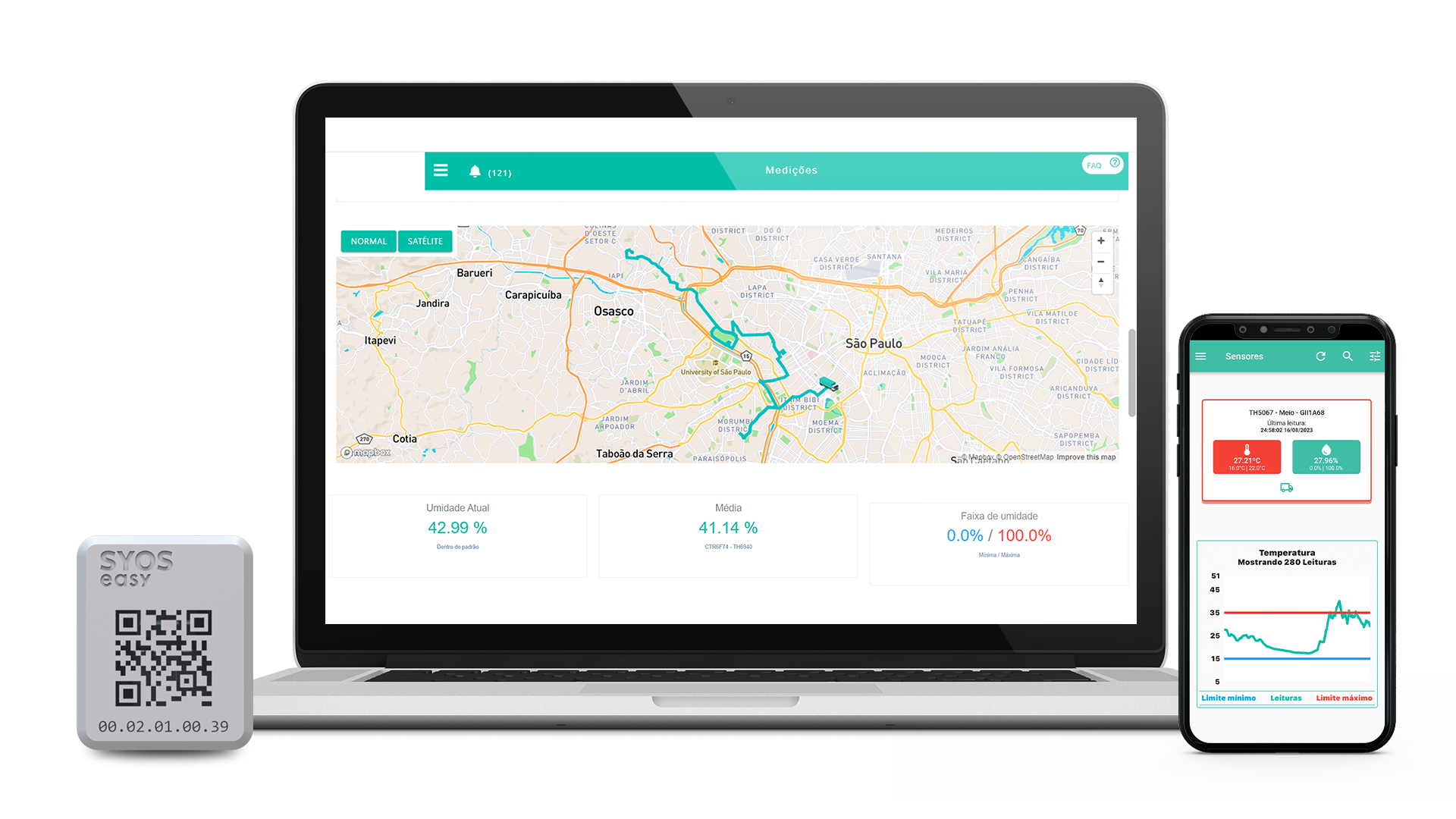
O controle de qualidade de medicamentos é uma área fundamental para o sucesso de indústrias farmacêuticas, seja dentro do ambiente de fabricação (RDC 658) ou nos ambientes de armazenagem e transporte (RDC 430 e RDC 653).
A SyOS sabe dessa importância e oferece uma tecnologia de monitoramento de temperatura e umidade que usa Internet das Coisas para ter dados acessíveis em tempo real e sem processos manuais.
Com a nossa solução, o Sistema de Gestão da Qualidade elimina processos manuais e erros na coleta de dados usando sensores automáticos e inteligentes. O acesso a dados em tempo real também dá maior capacidade preditiva para o SGQ visualizar possíveis desvios com antecedência e, com isso, acionar ações preventivas para evitar não conformidades.
Conheça a solução da SyOS para o setor farmacêutico e transforme o seu controle de qualidade.
Glossário: conheça os principais termos sobre o controle de qualidade farmacêutico

Para entender melhor alguns termos importantes para o controle de qualidade, criamos um glossário baseado na RDC 658/2022 da Anvisa. Confira!
Contaminação
Ocorre quando há a introdução não desejada de impurezas químicas, microbiológicas ou de matérias estranha nas matérias-primas, nos produtos intermediários ou nos produtos terminados.
Controle em processo
São verificações de qualidade realizadas durante a produção. Seu objetivo é monitorar e ajustar os processos em curso, as condições dos ambientes e os equipamentos, garantindo assim a conformidade.
Acordo técnico
É um documento que define responsabilidades, atribuições, direitos e deveres entre o contratante (indústria) e o contratado (que podem ser distribuidores ou transportes) em relação as atividades que serão prestadas. É importante para a execução de procedimentos que garantem a qualidade.
Ação preventiva
São ações que mitigam proativamente riscos. São importantes para evitar a ocorrência de desvios e não conformidades e podem, em alguns casos, eliminar as causas desses problemas em potencial.
Ação corretiva
São ações que representam uma reação a um desvio ou não conformidade que já ocorreu, e têm o objetivo de tratar ou eliminar sua causa.
Desvio
Ocorrem quando há o não cumprimento de requisitos determinados pelo Sistemas de Gestão da Qualidade.
Embalagem
Embalagem é um processo que inclui todas as etapas de acabamento de um produto. Inclui o envasamento, a rotulagem, etc.
Especificação
São documentos que descrevem em detalhes os requisitos que produtos ou materiais usados durante a fabricação devem atender. As especificações funcionam como diretrizes para avaliação da qualidade.
Procedimento
São descrições e diretrizes detalhadas das operações durante a fabricação de medicamentos, assim como as precauções necessárias e a medidas a serem aplicadas. Deve ter como foco auxiliar o gerenciamento do Sistema de Qualidade farmacêutica.
Instruções de processos
São documentos que descrevem de forma detalhada (mas acessível), como realizar cada etapa dos processos. Seu objetivo é facilitar a execução de tarefas rotineiras por operadores e analistas, por isso têm menor foco operacional, diferente dos procedimentos, que têm foco em diretrizes gerenciais.
Fabricação
Envolve todas as operações de preparo de um medicamento – aquisição de materiais, produção, controle de qualidade, liberação, armazenamento, expedição e outros controle relacionados.
Não conformidade e conformidade
As não conformidades são ocorrências que não correspondem aos procedimentos definidos pelo Sistema da Gestão da Qualidade (SGQ). As conformidades, por outro lado, são procedimentos executados conforme os padrões estabelecidos pelo SQG.
Produto intermediário
Produto parcialmente processado que ainda passará por etapas seguintes de processamento.
Produto a granel
É um produto que completou todos os estágios de processamento até, ou anterior, ao processo de embalagem primária.
Produto acabado
Produto que passou por todas as etapas de produção, incluindo rotulagem e embalagem final.
Qualificação
É uma ação que visa provar que instalações, equipamentos, utilidades e sistemas funcionam corretamente e geram os resultados esperados.
Validação
É uma ação que prova, de acordo com as Boas Práticas de Fabricação, que procedimentos, processos, equipamentos, materiais, atividades ou sistemas realmente geram os resultados esperados.
Registro
São documentos que fornecem evidências das ações adotadas. Seu objetivo é demonstrar a conformidade com as instruções determinadas para qualquer processo. Inclui dados sobre processos como a produção de lotes, atividades, investigações, eventos, distribuição, etc; assim como dados brutos que foram usados para as decisões do setor de qualidade.
Responsável técnico
É o profissional que garante que cada lote de produto acabado foi fabricado, testado e aprovado em conformidade com as leis e normas em vigor. Deve ser reconhecido pela autoridade regulatória nacional.
Eventos
Inclui desvios, não conformidades, etc.
Sistema de Ação Corretiva e Ação Preventiva (CAPAs)
São processos que utilizam ferramentas de gestão da qualidade ou de gerenciamento de riscos para identificar, avaliar e investigar eventos. Também definem planos de ação, sua execução e verificação, sempre com o objetivo de evitar reincidências.
Sistema informatizado
São sistemas que incluem a entrada de dados, o processamento eletrônico e a saída de informações a serem utilizadas para relatórios ou o controle automático.
Sobre a SyOS
Somos uma startup que tem o objetivo de revolucionar a cadeia do frio no Brasil, através de tecnologias de IoT e Inteligência Artificial aplicadas no monitoramento de produtos que precisam de uma temperatura ideal para manter sua qualidade, como alimentos, vacinas e medicamentos.
Com isso, empresas que atuam com a gestão do frio têm acesso a dados, relatórios e alertas que ajudam a tomar decisões para otimizar suas operações, evitar a não conformidade e reduzir prejuízos.
Descubra mais sobre a SyOS ou entre em contato com o nosso time de especialistas para conhecer melhor nossa solução.
![[GRÁTIS] POP farmácia em PDF + Planilha de controle de temperatura em geladeira de farmácia](https://no-cache.hubspot.com/cta/default/8356687/interactive-167487553962.png)