Validação de Sistemas Computadorizados (VSC): por que fazer, etapas e normas da Anvisa
A Anvisa exige que os sistemas computadorizados sejam validados antes de serem usados nas atividades do setor farmacêutico.
O processo de Validação de Sistemas Computadorizados (VSC) permite comprovar a efetividade dos sistemas nos procedimentos e nas rotinas de produção, armazenagem e transporte em que serão usados.
Mas por que uma empresa decide implementar um sistema desse tipo?
Quando uma operação busca um sistema computadorizado, ela visa automatizar processos ao mesmo tempo que em garante procedimentos mais precisos, seguros e invioláveis.
Por isso, se você atua em uma empresa de qualquer elo do setor farmacêutico, é importante que saiba como um sistema computadorizado funciona e por que eles devem ser validados.
Para saber essas respostas, continue a leitura esse guia SyOS.
O que é um sistema computadorizado?

Um sistema computadorizado não é apenas um software, mas um conjunto de processos que unem software, hardware, equipamentos, procedimentos e pessoas qualificadas.
Veja na imagem abaixo como um sistema computadorizado se insere no ambiente operacional farmacêutico:
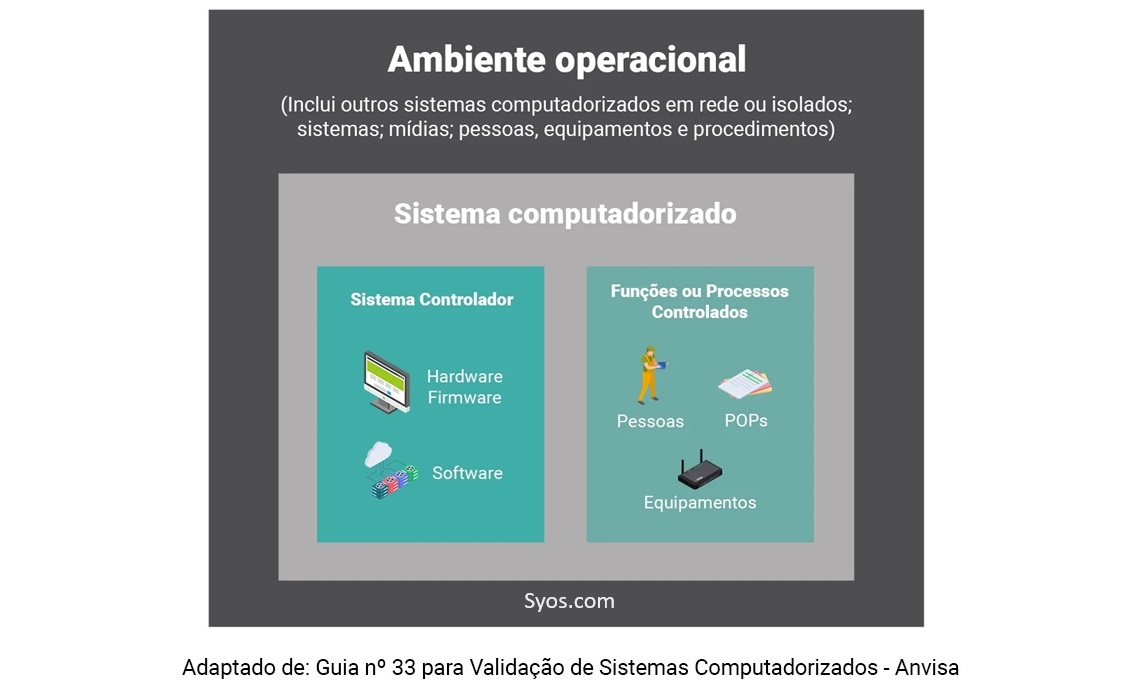
Todo sistema informatizado desenvolvido para uma atividade farmacêutica específica deve atender às normas reguladoras dessa atividade.
Veja abaixo quais são as principais resoluções e instruções da Anvisa para empresas que fabricam ou distribuem medicamentos:
- RDC 658: define as Boas Práticas de fabricação de medicamentos;
- RDC 430: define as Boas Práticas de distribuição, armazenagem e transporte de medicamentos;
- IN 138: define as Boas Práticas de fabricação de medicamentos relacionadas à qualificação e à validação;
- IN 134: define as Boas Práticas de fabricação de medicamentos relacionadas aos sistemas computadorizados.
Para entender como os sistemas computadorizados são utilizados nessas atividades — e por que eles precisam ser validados — continue a leitura.
O que é validação e por que é vantajoso ter um Sistema Validado?

Quando um sistema é validado, ele ganha um atestado de segurança, integridade e rastreabilidade.
Juntas, essas características mostram que o sistema segue as Boas Práticas que garantem a qualidade dos produtos e promovem a saúde das pessoas.
Veja alguns benefícios de ter um sistema validado:
- melhorias em Procedimentos Operacionais Padronizados (POPs);
- processos seguros e íntegros;
- conhecimento das ações necessárias para corrigir não conformidades e realizar manutenções;
- registro e rastreabilidade de dados;
- segurança de que o sistema funcionará com eficiência até sua descontinuação futura.
Como a validação deve ser conduzida?
A Anvisa define com detalhes as etapas da validação no Guia de Validação de Sistemas Computadorizados nº 33.
Esse guia se baseia em documentos internacionais de Boas Práticas farmacêuticas, como o GAMP 5, da International Society for Pharmaceutical Engineering (ISPE), e o 21 CFR Part 11, da FDA.
Por isso, ter um sistema validado de acordo com as recomendações de órgãos nacionais e internacionais é indispensável para negócios eficazes e que desejam manter sua competitividade.
Validação: por que escolher um sistema validável?

A opção por um sistema validável simplifica o processo de aquisição do sistema, assim como a validação futura.
Essa escolha, entretanto, depende de fatores como as especificações funcionais do sistema e os objetivos da empresa quer deseja adquirir. Se houver compatibilidade entre esses fatores, o sistema ajudará a empresa a garantir as Boas Práticas regulatórias.
Esse é o caso do sistema validável da SyOS que monitora temperatura e umidade de acordo com as regras da Anvisa e do 21 CFR Part 11 da FDA.
Ciclo de vida: da implementação à aposentadoria dos sistemas computadorizados
Todo sistema computadorizado tem um ciclo de vida dividido por fases.
Esse ciclo começa quando uma empresa decide implementar um sistema e realiza estudos iniciais para saber quais são os objetivos dessa implementação; ele termina quando o sistema é descontinuado e substituído por um novo.
Veja abaixo quais são as fases do ciclo da vida dos sistemas computadorizados:
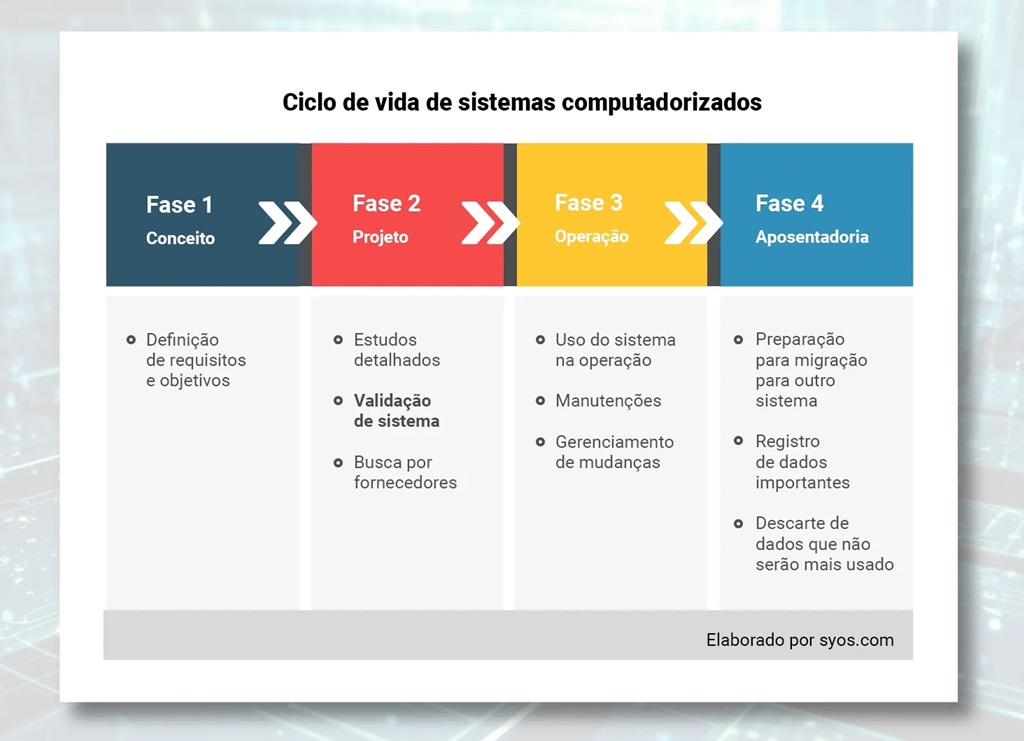
Cada fase do ciclo de vida exige diferentes processos operacionais e pessoal qualificado para desempenhá-los.
É na fase 2 (projeto) que ocorre a validação do sistema, e ela envolve uma série de documentações. Descubra o que deve constar na validação dos sistemas computadorizados a seguir.
Como é feita a Validação de um Sistema Computadorizado (VSC)?

A validação dos sistemas computadorizados é feita em várias etapas, que envolvem diferentes documentações e também negociações com fornecedores que atendem aos requisitos da empresa contratante.
Na imagem abaixo, você pode ver um esquema resumido da validação de sistemas computadorizados:
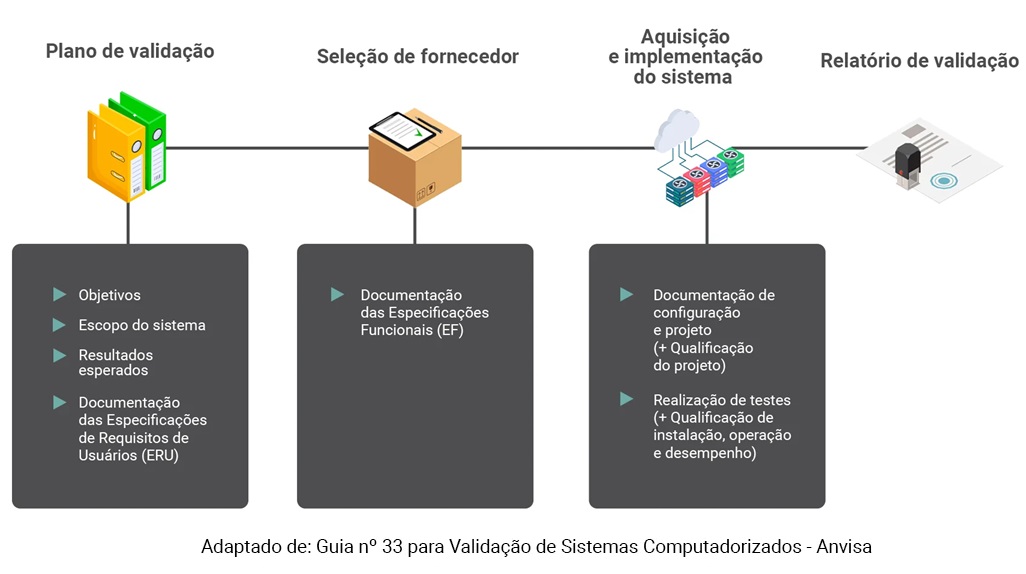
Caso opte por executar a validação, a empresa que vai implementar o sistema computadorizado deve seguir todas essas etapas da validação. Veja baixo alguns detalhes de cada uma:
Plano de validação
Na etapa de planejamento, a empresa deve descrever todo o projeto do sistema que será adotado. Nesse projeto devem estar descritos:
- ações necessárias para a validação;
- o uso pretendido para o sistema,
- critérios para aceitação e liberação do sistema;
- responsáveis por cada processo.
No plano de validação de sistemas informatizados da Anvisa também devem estar as abordagens para o gerenciamento do risco à Qualidade, resultados esperados com o uso dos sistemas e as mudanças de Procedimentos Operacionais Padrão (POPs).
Documentação das Especificações de Requisitos de Usuários (ERU)

As Especificações de Requisitos de Usuários (ERU) são documentos que definem o que a empresa regulada — ou seja, o usuário — espera do sistema que vai adquirir.
Todos esses requisitos devem ser específicos, mensuráveis, atingíveis, realísticos e testáveis. Além disso, eles devem ser compatíveis com as normas da atividade prestada — fabricação, armazenagem ou transporte.
No caso da aquisição de um sistema computadorizado já disponível no mercado, as ERU podem ser fornecidas pelo próprio fornecedor.
Veja alguns exemplos de requisitos de usuários:
- detalhamento do ciclo de vida do sistema
- restrições e migração de dados eletrônicos;
- requisitos operacionais e funcionais.
Todos os requisitos listados pela contratante também devem ser classificados em níveis de prioridade:
- alta prioridade: o requisito é mandatório porque têm grande impacto na qualidade;
- média prioridade: o requisito é benéfico porque tem impacto moderado na qualidade;
- baixa prioridade: mesmo sem grande impacto na qualidade, o requisito favorece algum processo.
Essa escala de prioridade deve orientar todo o processo de seleção do fornecedor para que o sistema seja compatível com esses requisitos. Veja mais detalhes a seguir.
Seleção de fornecedor

A contratação e a qualificação de fornecedores devem ocorrer com base nas Especificações de Requisitos de Usuários (ERU) definidas na etapa anterior.
A avaliação de um fornecedor que atende que atendes a esses requisitos pode ser de três tipos:
- avaliação básica com base nas informações disponíveis;
- auditoria por meio de formulário;
- auditoria com visita ao fornecedor realizada por um especialista, auditor ou time de auditoria.
A escolha por cada método depende do nível de impacto que o sistema terá na qualidade operacional.
No caso do setor farmacêutico, os sistemas para monitoramento de temperatura e umidade têm alto impacto na qualidade dos produtos e dos processos, por isso a análise do fornecedor deve ser criteriosa.
Se você está nessa etapa do processo de validação, fale agora com a SyOS para conhecer as especificações do nosso sistema validável de acordo com os requisitos da Anvisa.
Documentação das Especificações Funcionais (EF)
A documentação das Especificações Funcionais (EF) deve demonstrar que o sistema selecionado atende aos requisitos de usuário da empresa que está contratando o serviço.
Nesse documento, é necessário informar o que o sistema deve fazer e que funções e instalações serão fornecidas. Ele é cedido pelo fornecedor contratado, mas deve ser revisto e aprovado pela empresa contratante, já que sua operação está sujeita à regulação da Anvisa.
Veja alguns itens que devem constar no documento de Especificações Funcionais (EF) do sistema:
- restrições de projeto (como velocidade, potência, testes, condições operacionais etc);
- hierarquia de dados fornecidos, assim como meios de acesso, verificação, migração e manutenção da integridade;
- interfaces (de usuários, de equipamentos e com outros sistemas);
- glossário e convenções de nomenclatura (os termos técnicos e conceituais usados devem ser padronizados e entendíveis por todos os envolvidos).
Em um sistema de monitoramento de temperatura e umidade, por exemplo, esse documento deve descrever que instrumentos são utilizados, como são instalados, como medem as condições ambientais e que tipo de informações trazem.
Veja alguns detalhes sobre o sistema de monitoramento da SyOS.
Documentação de configuração e projeto
Na fase de aquisição e instalação do sistema, caso o sistema tenha opções configuráveis, essas especificações devem ser cedidas para que a empresa contratante faça as configurações necessárias e o sistema atenda aos seus requisitos.
Já o documento de projeto deve ter especificações de hardware e software, incluindo todos os componentes de arquitetura ou interface. É nessa etapa de documentação que ocorre a Qualificação de Projeto (QP).
Realização de testes (+ outras qualificações)
Com o sistema implementado e a documentação formulada, é necessário realizar testes para verificar o seu funcionamento.
A execução desses testes é fundamental para qualificar a instalação, a operação e o desempenho do sistema.
Os testes devem ter planos para sua execução e, após sua realização, os resultados devem ser registrados em relatórios.
Veja alguns objetivos atendidos pelos testes:
- identificação de defeitos;
- prevenção de falhas;
- produção de evidências de que o sistema executa suas funções;
- atendimento de requisitos regulatórios.
Relatório de validação

A última etapa é a elaboração do relatório de validação. Nele deve constar tudo que é relacionado à segurança, à qualidade e à integridade do sistema.
A complexidade do relatório deve ser compatível com o nível de risco à qualidade caso o sistema não funcione como era esperado. Por isso, o documento deve descrever:
- as atividades executadas utilizando o sistema implementado;
- os resultados obtidos (incluindo desvios do que foi previamente planejado e ações corretivas esperadas para esses desvios);
- Procedimentos Operacionais Padronizados (POPs) necessários para o suporte operacional;
- a avaliação do fornecedor escolhido;
- treinamentos para o uso do sistema.
Neste post, você viu um resumo das etapas necessárias para a validação de sistemas computadorizados no setor farmacêutico.
Você pode consultar mais detalhes sobre a validação no Guia 33 da Anvisa para Validação de Sistemas Computadorizados.
Aproveite para conhecer o sistema validável de monitoramento da SyOS.
Monitore com o Sistema Validável da SyOS

O sistema de monitoramento da SyOS é validável e segue todas as especificações funcionais exigidas pela Anvisa para o controle de temperatura e umidade de medicamentos biológicos, termolábeis e vacinas.
Conheça a nossa atuação na cadeia de produção e distribuição farmacêutica e entre em contato para garantir qualidade na sua operação.
Sobre a SyOS
Somos uma startup que tem o objetivo de revolucionar a cadeia do frio no Brasil, através de tecnologias de IoT e Inteligência Artificial aplicadas no monitoramento de produtos que precisam de uma temperatura ideal para manter sua qualidade, como alimentos, vacinas e medicamentos.
Com isso, empresas que atuam com a gestão do frio têm acesso a dados, relatórios e alertas que ajudam a tomar decisões para otimizar suas operações, evitar a não conformidade e reduzir prejuízos.
Descubra mais sobre a SyOS ou entre em contato com o nosso time de especialistas para conhecer melhor nossa solução.